ЭКЗОСОМЫ КАК ЭЛЕМЕНТ РЕГУЛЯТОРНОЙ СИСТЕМЫ ОРГАНИЗМА
Абрамов А.А.4, Поспелов В.И1, Корицкий А.В.1, Румянцев С.А.2, Румянцев А.Г.2,3
1. ООО Импульс жизни, Москва
2. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
3. ФГБУ Национальный научно-практический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева Минздрава России
4. Государственное бюджетное учреждение здравоохранения города Москвы "Научно-практический центр специализированной медицинской помощи детям имени В.Ф. Войно-Ясенецкого Департамента здравоохранения города Москвы"
ВВЕДЕНИЕ
Экзосомы представляют собой мембранные везикулы диаметром 30-150 нм, которые получены в результате экзоцитоза внутриклеточных везикул многих типов клеток, включая иммунные клетки, стволовые клетки, опухолевые клетки. Экзосомы участвуют в межклеточном взаимодействии, доставляя их содержимое в клетки-мишени путем прямого контакта между клетками или без него и, тем самым, влияя на физиологические и патологические процессы. Они присутствуют в различных жидкостях организма и содержат белки, нуклеиновые кислоты, липиды и микро-РНК, которые можно транспортировать в окружающие клетки. Было обнаружено, что молекулярные компоненты в экзосомах связаны с некоторыми заболеваниями и ответами на лечение, что указывает на то, что они могут иметь применение в диагностике с помощью молекулярной визуализации и обнаружения биомаркеров. Кроме того, недавние исследования показали, что экзосомы имеют иммунотерапевтическое применение или могут выступать в качестве системы доставки лекарств для целенаправленной терапии препаратами и биомолекулами. В этом обзоре мы описываем формирование, структуру и физиологическую роль экзосом, кроме того, обобщаются текущие знания о физиологических и патологических ролях экзосом, а также их диагностических и терапевтических целях, в том числе возникающие на основе экзосомы методы лечения, которые до сих пор не применялись.
БИОГЕНЕЗ ЭКЗОСОМ Экзосомы представляют собой мембранные везикулы, полученные из клеток диаметром 30-150 нм, которые имеются в поздних эндосомах (таблица 1) [1,2,3,4]. Мембранные рецепторы, растворимые белки, липиды, РНК и даже органеллы могут быть упакованы в экзосомы как грузы, которые могут функционировать в клетках-мишенях. В качестве первого этапа процесса биогенеза экзосомы часть клеточной мембраны погружается в клетку, образуя раннюю эндосому. Затем ранние эндосомы трансформируются в поздние, заполненные внутрипросветными везикулами (ILVs), то есть мультивезикулярными телами (MVB) при участии связанных с эндоцитозом белков, комплексов Ras с надсемейством GTPase Rab и липидной основы. MVB являются предшественниками экзосом. Состав экзосомы отражает активность ILV, а их биогенез связан с созреванием эндосом. Наконец, ILV высвобождаются из MVB во внеклеточную среду, генерируя экзосомы [5,6]. Генерация экзосомы может быть либо зависимой от комплексов эндосомальной сортировки, которые необходимы для транспорта (ESCRT), или не независимо от них (рис.1).
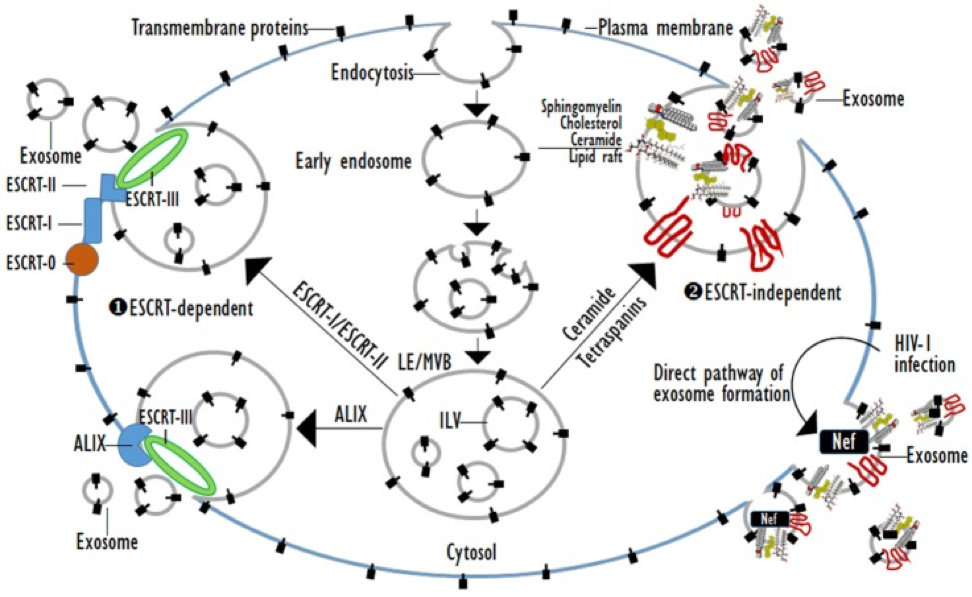
Рисунок 1.
ESCRT-зависимый и ESCRT-независимый биогенез экзосом.
Таблица 1. Классификация эукариотических клеток, генерирующих экзосомы
|
|
Размер (диаметр) (нм) |
Плотность (г/мл) |
Происхождение |
Состав |
|
Экзосомы |
30-150 |
1,07-1,18 |
Эндолизосомальный сигнальный путь большинства типов клеток |
РНК, белки/пептиды, клеточный детрит |
|
Микровезикулы |
100-1000 |
различна |
Цитоплазматическая мембрана большинства типов клеток |
РНК, белки/пептиды, клеточный детрит |
|
Апоптотические тельца |
50-5000 |
1,24-1,28 |
Цитоплазматическая мембрана всех типов клеток |
РНК, белки/пептиды, клеточный детрит |
Белковые комплексы ESCRT подразделяются на четыре группы: ESCRT-0, -I, -II и -III [7]. Эти комплексы последовательно собираются на цитозольную поверхность эндосомной мембраны и приводят к внутреннему почкованию и делению мембраны с образованием ILV. ESCRT-0 инициирует путь ESCRT в эндосомах, потому что он может связывать фосфатидилинозитол-3-фосфат и убиквитин. Две субъединицы ESCRT-0, а именно Hrs и STAM1 / 2, связывают убиквитированные грузы. ESCRT-0 рекрутируется в эндомомы до MVB, потому что FYVE-домен субъединицы Hrs связывает фосфатидилинозитол-3-фосфат [8]. ESCRT-I и -II также имеют домены ubiquitin-взаимодействия и сортируют убиквитинированные грузы при ILV с ESCRT-0. ESCRT-I и ESCRT-II вербуют ESCRT-III, который стимулирует инвагинацию и сужение мембраны [9]. Комплексы ESCRT накапливают убиквитинированные грузы в экзосомах, содержащих как мембранные, так и цитоплазматические белки. Субъект комплекса ESCRT-1 TSG101 необходим для экзосомальной секреции. Некоторые грузы могут быть нацелены на MVB, не требуя взаимодействия с ESCRT-0, -I и -II. ALIX, который является ESCRT-взаимодействующим белком, связывается с G-мембранным рецептором PAR1 и компонентом ESCRT-III CHMP4 и тем самым функционирует при сортировке PAR1 в качестве груза для MVB независимо от ubiquitylation. ALIX также взаимодействует с белком syntenin scdeolding PDZ, который связывает синдиканы и CD63 как лигандные группы PDZ. Таким образом, ALIX, синтенин, синдекан и CD63 совместно накапливаются в MVB и, следовательно, экзосомы независимо от убиквитинирования [9,10]. Липид- и тетрасапин-требуемый биогенез экзосом происходят через ESCRT-независимые пути. Некоторые белки нацелены на экзосомы с помощью тетраспанинов или липидации белков, включая модификацию гликозилфосфатидил-инозитола и модификации насыщенных жирных кислот. Экзосомы сильно обогащены тетраспанинами, которые имеют четыре трансмембранных домена, которые содержат отдельные сайты пальмитоилирования. Тетраспанины, такие как CD9, CD63, CD37, CD81 и CD82, особенно обильны в экзосомальной мембране и используются в качестве биомаркеров экзосомы [11]. CD55, CD58 и CD59, которые представляют собой гликозилфосфатидил-изотилосодержащие белки, а Lyn, являющийся пальмитоилированным белком, нацелены на экзосомы во время созревания ретикулоцитов. Белки с этими липидными модификациями избирательно завербовываются в липидные плоты, которые состоят из сфингомиелина, холестерина и церамида. Липидные плоты концентрируются в экзосомных мембранах [6, 12]. Как более непосредственный путь независимого от ESCRT биогенеза экзосомы, заражение клеток вирусом иммунодефицита человека (ВИЧ) -1 увеличивает клеточное высвобождение экзосом. Экзосомы от ВИЧ-1-положительных индивидуумов содержат вирусный белок Nef, который привязан к микродоменам липидного плота. Эти экзосомы содержат тетрасанины-CD63 и CD81, которые являются классическими маркерами экзосомы и имеют такой же размер, что и классические экзосомы [1,13]. Экзосомы, полученные из многих типов клеток, возникают в качестве несущих грузы ILV в пределах LE или MVB. Биогенез экзосомы может быть индуцирован комплексом ESCRT, липидными плотами и тетрасанинами. Комплексные кластеры ESCRT-0 - убиквитированные грузы, комплексы ESCRT-I и -II направляют мембранный почкование, а комплекс ESCRT-III служит в качестве «молекулярных ножниц», которые расщепляют сформированные везикулы из мембраны. Экзосомы сильно обогащены сфингомиелином, холестерином и церамидом, которые концентрируются в мембранных липидных плотах. Высоколегированные микродомены липидного плота участвуют в эндоцитарных и экзоцитарных процессах. Тетраспанины играют определенную роль в формировании экзосомы. Белки семейства tetraspanin, которые содержат четыре trnasmembranous домены, выбирают грузы для секреции экзосомы. Тетраспанины многочисленны в ILVs MVB и в экзосомах. Кроме того, Nef, дополнительный белок, кодируемый ВИЧ-1, индуцирует внеклеточное высвобождение экзосом.
ПАТОФИЗИОЛОГИЯ ЭКЗОСОМ
Физиологические роли экзосом
В качестве клеточных внеклеточных пузырьков (EV) экзосомы опосредуют межклеточную связь и тем самым участвуют в регуляции различных биологических процессов. Экзосомы могут влиять на клетки-реципиенты посредством рецептор-опосредованных взаимодействий или путем доставки биологически активных молекул груза, таких как белки, мРНК и микроРНК (miRNAs), когда экзосомы поглощаются клетками-реципиентами через эндоцитоз, мембранную комбинацию или фагоцитоз [6 ]. Тип и физиопатологическое состояние родительских клеток определяют составляющие и структуру экзосом. Экзосомы являются потенциальными транспортерами нескольких биомолекулярных групп, включая белки, пептиды, липиды, ДНК, мРНК и miRNA (рис.2).
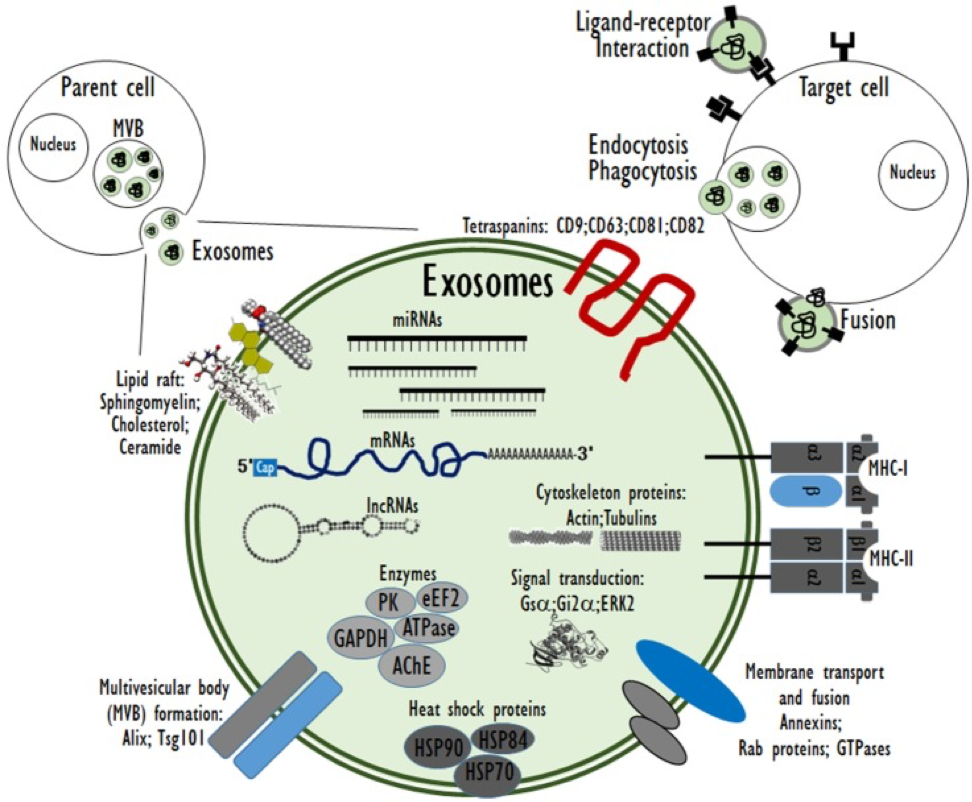
Рисунок 2. Состав экзосомы и взаимодействие с клетками-мишенями.
В частности, генетические материалы, такие как мРНК и miRNA, как экзосомный груз, могут быть переведены или регулировать экспрессию генов в клетках-реципиентах или мишенях [14]. Таким образом, экзосомы могут быть вовлечены в нормальные физиологические процессы, такие как иммунные реакции, нейробиологические функции и синаптическую пластичность, дифференцировку клеток, поддержание и пластичность стволовых клеток и восстановление тканей [15]. Экзосомы выгружаются из многих типов клеток, включая эритроциты, тромбоциты, лимфоциты, дендритные клетки и раковые клетки [16,17,18]. In vivo экзосомы присутствуют в большинстве жидкостей организма, включая спинномозговую жидкость, грудное молоко, кровь, мочу, слюну, амниотическую жидкость и выпарки из асцита. В крови экзосомы присутствуют при концентрации почти 3 миллионов экзосомов на микролитр [19]. Фундаментальные процессы, с помощью которых экзосомы обмениваются своим содержимым с клетками-реципиентами, до сих пор не были четко определены. Некоторые исследования показали, что экзосомы могут сливаться с клеточной мембраной клеток-реципиентов, что приводит к введению содержимого экзосомы в клетку-реципиент [20,21,22]. Этот процесс экзосомы, сливаясь с клеточной мембраной клетки-реципиента, особенно благоприятствует кислой среде, подобной той, что содержится в раковых клетках (фиг.3).
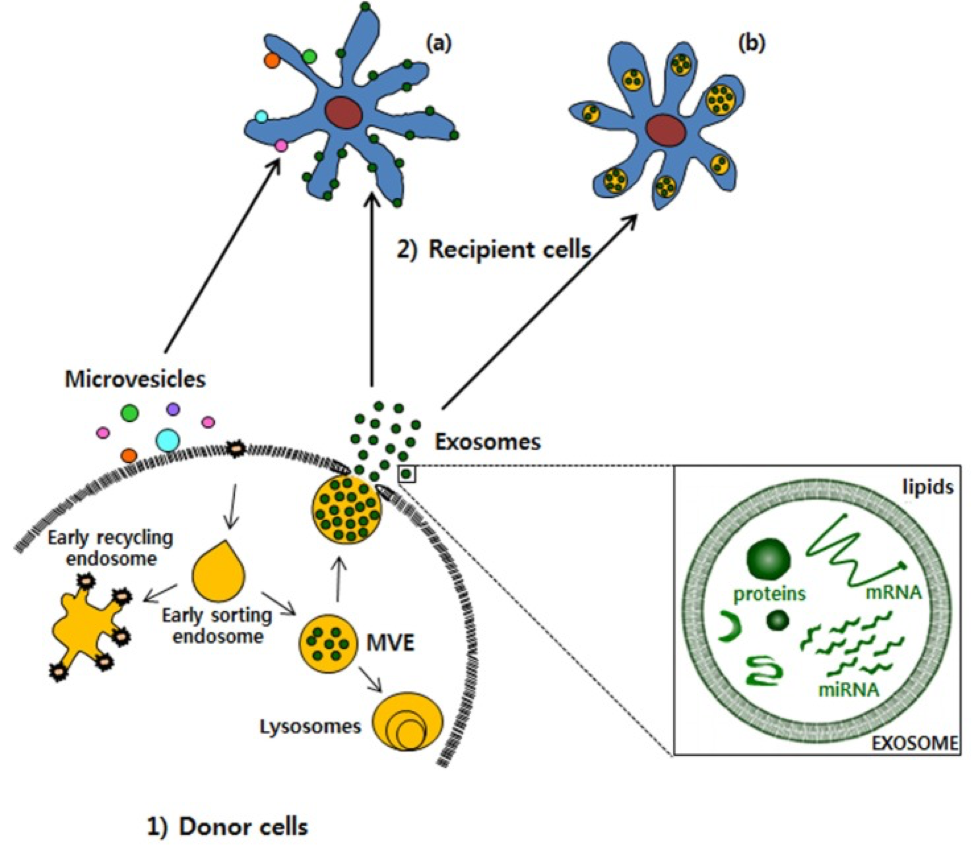
Рисунок 3. Транспортировка экзосом из 1) донорских клеток в 2) клетки-реципиенты.
Экзосомы выделяются из клеток-доноров и поглощаются клетками-реципиентами. Экзосомы могут быть (а) слиты с плазматической мембраной или быть (б) интернализованными клетками-реципиентами. MVE, мультивезикулярная эндосома.
Компоненты, биогенез и разрядка экзосомы являются строго направленными процедурами, на которые влияют различные активирующие раздражители и сигналы напряжения, которые отражают изменения в условиях окружающей среды. Кроме того, высвобождение экзосомы является эффективным адаптивным механизмом, посредством которого клетки регулируют свои внутренние стрессовые состояния и внеклеточную среду [23]. Стрессовые состояния часто возникают в микроокружении опухоли и должны быть перегружены раковыми клетками, чтобы позволить рост опухоли против неблагоприятных состояний, таких как гипоксия, химиотерапия рака, облучение, голодание или другие факторы пациента. Гипоксия также приводит к подкислению микроокружения опухоли, которая может оказывать интенсивное воздействие на трафик ЭВМ, поскольку секреция и поглощение EV остаются активными в кислых условиях [21]. Таким образом, лечение экзосомной медикаментозной терапией при раковых заболеваниях зависит от различных стрессовых ситуаций [24] и может способствовать развитию рака посредством взаимодействия между раковыми клетками и соседней стромой, стимуляции пролиферативной и ангиогенной сигнализации, прогрессирования иммунной репрессии и инициирования преметастатических ниш (фиг.4) [22, 25, 26, 27, 28].
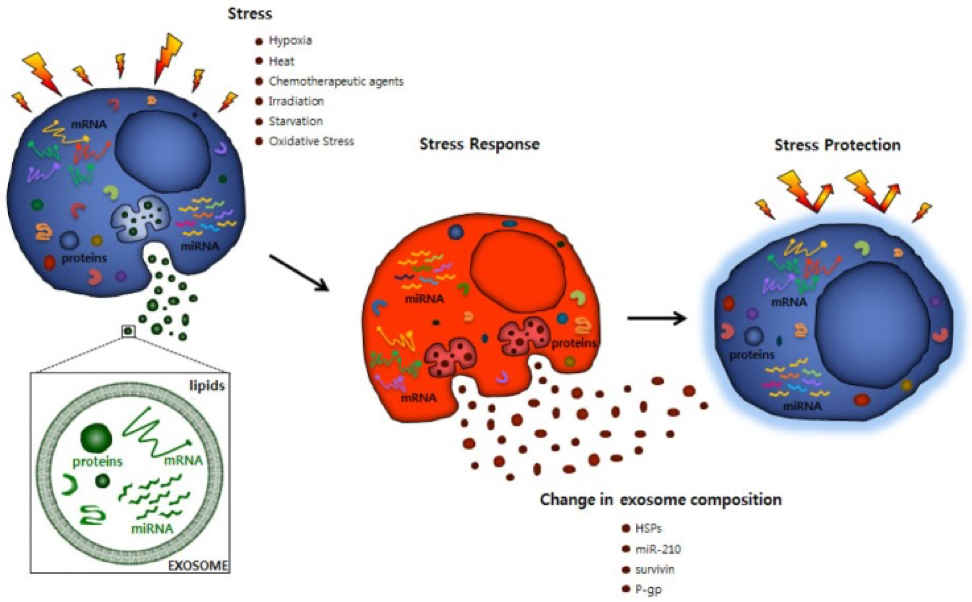
Рисунок 4. Изменение экзосомальных молекулярных композиций и клеточного ответа от стресса.
HSP, белки теплового шока; P-gp, пермеабилизирующий гликопротеин.
Другие исследования показали, что экзосомы связываются на клеточной поверхности клеток-реципиентов через специфические рецепторы [29] или подвергаются интернализации эндоцитозом или микропиноцитозом после слияния с внутренними срезами [30,31]. Известно, что экзосомы играют решающую роль в большинстве физиологических процессов в тканях и органах. Поскольку экзосомы секретируются многими типами клеток, включая иммунные клетки, нервные и стволовые клетки, они могут быть вовлечены в различные физиологические процессы, такие как представление антигена [32], перенос РНК между клетками [33] или восстановление тканей [34]. Экзосомы наиболее интенсивно изучали свои роли в следующих областях: в иммунологии, регулирующих поведение лимфоцитов и макрофагов; в сердечно-сосудистой системе, регулирующей коагуляцию, ангиогенез и тромбоз; в центральной нервной системе (ЦНС), регулирующей включение нейронов и глиальных клеток, включая астроциты, олигодендроциты и микроглии в регуляцию синаптической функции, нейронную пластичность, нейролепалиальную связь и миелинизацию; и в костях, регулирующих экспрессию конкретных ферментов. Общим механизмом, который активен во многих из вышеперечисленных процессов, является обмен РНК между клетками посредством торговли ЭВ [35,36,37,38,39,40,41,42]. Обширные исследования были проведены по факториальному эффекту экзосом в иммунном ответе [36], и их роль в представлении антигена также была широко представлена [43]. Иммунный ответ представляет собой сложный процесс, включающий как врожденный, так и приобретенный иммунитет [44]. Эти ответы могут контролироваться различными компонентами экзосом, включая белки, РНК и липиды, и этот процесс называют иммуномодуляцией. Сообщалось также о роли экзосом в коагуляции, воспалении и ангиогенезе [22]. После их активации тромбоциты секретируют экзосомы, а также проливают другие микропузырьки [45]. Было обнаружено, что активированные активированные тромбоциты экзосомы не выполняют какую-либо роль в коагуляции, но их содержание miR-223, miR-339 и miR-21 может переноситься в клетки гладкой мускулатуры и ингибировать экспрессию тромбоцитарного фактора роста β, и эти экзосомальные miRNAs могут использоваться в качестве биомаркеров для прогнозирования атеросклероза [46]. Сообщалось, что экзосомы участвуют в клетках Dictyostelium по сигналам хемоаттрактанта [47]. Исследования по содержанию miRNA экзосомы в материнском молоке показали, что miR-155 и miR-181a, которые играют важную роль в иммунной регуляции, присутствовали в высокой концентрации в течение первых 6 месяцев лактации, но были значительно уменьшены после этого [48, 49]. В некоторых исследованиях сообщалось, что экзосомы не только участвуют в инициировании нисходящей передачи сигналов, но также специально нацеливают клетки-реципиенты и обменивают определенные белки и нуклеиновые кислоты с этими клетками [50]. Экзосомы имеют уникальные функции в опосредовании межклеточной коммуникации между соседними и удаленными клетками в организме. Аналогично, экзосомы играют уникальную роль в распространении патогенов, таких как вирусы и прионы, из клеток в ранее неинфицированные [51].
Патологические роли экзосом
Было обнаружено, что экзосомы обладают патофизиологическими функциями при заболеваниях, включая рак, инфекционные заболевания, аутоиммунные заболевания, метаболические заболевания, сердечно-сосудистые заболевания и нейродегенеративные расстройства. Основываясь на их целостном содержании, экзосомы играют важную роль в продвижении прогрессирования опухоли благодаря их способностям стимулировать клеточную пролиферацию, ангиогенез, ремоделирование внеклеточного матрикса, метастазы и стимулирование иммунного эпиднадзора [6]. Экзосомы влияют на клетки-реципиенты, перенося канцерогенные биомолекулы в качестве их продуктов. При вводе клеток-мишеней эти грузы способствуют развитию фенотипа рака в клетках-реципиентах [52]. Несколько молекул, которые действуют как индукторы эпителиально-мезенхимального перехода, могут переноситься в опухолевые клетки как грузы экзосом. Поскольку эпителиально-мезенхимный переход является критическим событием, которое инициирует инвазию рака и метастазы, экзосомы могут способствовать развитию высокого уровня злокачественности в опухолевых клетках [6]. Важно отметить, что экзосомы могут распространять многочисленные патогены, в том числе ВИЧ, вирус Эпштейна-Барра, цитомегаловирус, вирус гепатита С, вирус простого герпеса, токсоплазменную оболочку, лейшманию, Plasmodium spp., Mycobacterium spp., Salmonella Typhimurium, Mycoplasma spp. И прионы посредством выборочной доставки патогенных продуктов. После экспериментальных инфекций с патогенами в клетках или животных были идентифицированы грузы экзосом, которые содержат компоненты донорной клетки наряду с многочисленными компонентами, полученными из патогенов [53]. Экзосомы могут активировать или подавлять иммунные ответы, распространяя микробные и донорные компоненты за пределы инфицированной клетки. Кроме того, инфицированные клетки-экзосомы могут взаимодействовать с неиммунными клетками, включая эпителиальные клетки, фибробласты, мезенхимальные клетки, тромбоциты и сосудистые клетки и, таким образом, могут влиять на исход инфекции [53]. Экзосомы также могут опосредовать распространение нейродегенеративных заболеваний. В качестве инструмента для межнейронной коммуникации экзосомы могут не только способствовать локальной синаптической пластичности, но и обеспечивать связь в ЦНС, что влияет на отдаленные нейронные сети. Это могло бы обеспечить механизм локального распространения нейродегенеративных заболеваний в головном мозге, потому что экзосомы, содержащие несогласованные, агрегированные формы нейродегенеративных связанных с заболеванием белков, существуют в спинномозговой жидкости и крови пациентов [54]. Эти данные свидетельствуют о том, что нейродегенеративные заболевания могут передаваться в мозге через экзосомы [55]. Экзосомы повышаются в метаболическом синдроме и способствуют его патофизиологическим проявлениям, таким как сосудистые осложнения, воспаление и коагулопатия крови [56]. Экзосомы еще больше увеличиваются в метаболическом синдроме, и это изменение часто сопровождается сосудистыми осложнениями, включая атеросклероз. Увеличение избытка экзосом также связано с ожирением [57]. Сообщалось, что при ожирении и сахарном диабете 2-го типа количество избыточных экзосом значительно уменьшается после калорийного ограничения или бариатрической хирургии, и в результате нормализация гликемического контроля отражает ослабление воспаления [58]. Было обнаружено, что обилие экзосом в циркуляции возрастает во многих воспалительных состояниях, включая сердечно-сосудистые заболевания [59]. Экзосомы вызывают выделение цитокинов и хемокинов из эндотелиальных клеток и способствуют распространению эндотелиальных провоспалительных каскадов. Напротив, экзосомы, выделенные из апоптотических эндотелиальных клеток, тромбоцитов, эндотелиальных клеток-предшественников или ишемической мышцы, показали некоторые благоприятные эффекты, такие как стимуляция пролиферации эндотелия, миграция, образование трубки in vitro и эндотелиальный ремонт. Эти полезные функции EV изменяются при диабете. Циркулирующие эндотелиальные экзосомы также коррелируют с сердечно-метаболическими факторами риска, особенно с дислипидемией [60]. Уремия как сердечно-сосудистый фактор риска также коррелирует с увеличением количества экзосом тромбоцитов в кровообращении до запуска тромбоза. Гиперурикемия у пациентов с хронической почечной недостаточностью может привести к повышенному риску сердечно-сосудистых событий. Таким образом, при гипергликемии, дислипидемии и гиперинсулинемии, а также при гиперурикемии и уремии экзосомы могут способствовать развитию сердечно-метаболического заболевания через их прокоагулянтную активность и уменьшенную поддержку эндотелиальной функции [61]. Экзосомы также способствуют прогрессированию аутоиммунных заболеваний. Поскольку они могут содержать аутоантигены, которые участвуют в аутоиммунных заболеваниях. Было обнаружено, что экзосомы, выделенные из синовиальных жидкостей, содержат аутоантигенные белки, которые могут быть вовлечены в развитие ревматоидного артрита (РА). Факторы некроза опухолей-α-положительные экзосомы, выделенные из синовиальных фибробластов, полученных у пациентов с RA, ингибируют апоптоз Т-клеток, что еще более усугубляет RA [62,63].
РОЛЬ ЭКЗОСОМ В ТЕРАНОСТИКЕ
Диагностические инструменты, основанные на анализе экзосом
Экзосомы считаются инновационными целями [64,65]. Различные биологические жидкости организма, включая грудное молоко, слюну, сыворотку, плазму, амниотическую жидкость, злокачественную асцитную жидкость и мочу, содержат многочисленные экзосомы, которые могут быть выделены [66,67,68]. Exosome может иметь клинические применения как в качестве диагностических биомаркеров, так и в качестве терапевтических инструментов. Клетки переносят экзосомы как в нормальных, так и в патологических состояниях. Экзосомы могут переносить различные нуклеиновые кислоты и белки, которые предоставляют информацию о патологических состояниях из донорских клеток, и они, как считается, обладают сильным потенциалом для хранения ценных биомаркеров для экспериментальной и клинической диагностики. Специфические мРНК / miRNAs были обнаружены в экзосомах, выделенных из сыворотки пациентов с глиобластомой или карциномой яичников [22,69]. Поскольку это простой процесс выделения экзосомы из биологических жидкостей, они являются привлекательными в качестве диагностических маркеров рака и других патологических состояний. Опухолевые клетки описаны для высвобождения повышенного количества экзосомы по сравнению с неопухолевыми клетками [70]. Такие экзосомы, полученные из опухоли, обладают характерными геномными и протеомными сигнатурами; таким образом, они представляют собой подходящие мишени для диагностики рака. Однако эти экзосомы могут стимулировать онкогенный потенциал клеток-реципиентов [71]. В нескольких исследованиях показано, что экзосомы, высвобождаемые опухолевыми клетками, влияют на развитие, дифференцировку и метастазирование раковых клеток [22,72,73,74]. Клинические исследования экзосомы у пациентов с раком легкого и меланомой уже выполнены [75,76]. Тетраспанины, которые являются семейством мембран, связанных с белками, обильны в экзосомах. Экзосомальный маркер CD63 относится к семейству тетраспанинов, и было установлено, что обилие экзосом в CD63 в плазме значительно увеличивается у пациентов с меланомой по сравнению со здоровыми контролями [70]. Совсем недавно сравнительный анализ экзосомального белка проводился при различных типах рака человека, и результаты показали, что CD63 был выше в экзосомах, полученных из злокачественных раковых клеток, чем в тех, которые получены из не-раковых клеточных линий, что дает дополнительные доказательства того, что экзосомальный CD63 может быть биомаркером рака [77]. Мочевые экзосомальные белки также изучались как потенциальные биомаркеры для рака мочевого пузыря и рака предстательной железы. Потенциальные экзосомные биомаркеры для рака мочевого пузыря включают восемь экссузоральных белков мочевой системы, а именно пять белков, связанных с рецепторным путем эпидермального фактора роста, α-субъединицу белка Gs, резистина и протеина 3, вызванного ретиноевой кислотой, которые были идентифицированы путем сравнения протеомные профили мочевых экзосом между пациентами с раком мочевого пузыря и здоровым контролем [78]. Более того, изобилие 24 экссузоральных белков мочевыводящих путей значительно различалось между раком мочевого пузыря и пациентами с грыжей (контроль) [79]. Раннее выявление и диагностика рака предстательной железы может быть достигнуто с использованием теста на антиген простаты; однако у него есть проблемы с низкой специфичностью и высокой частотой ложных срабатываний, что может привести к чрезмерной обработке рака лёгких предстательной железы. Поэтому новые биомаркеры с более высокой диагностической точностью очень нужны для рака предстательной железы. Циркулирующая концентрация miRNA-141 является надежным диагностическим биомаркером для рака предстательной железы [80]. Кроме того, сообщалось, что концентрация miRNA-141 и miRNA-375 в сыворотке коррелирует с прогрессированием рака предстательной железы [81]. Экзосомальные miRNAs являются основным компонентом устойчивых к РНКазе miRNAs в образцах сыворотки или плазмы [80, 82], поэтому вполне вероятно предположить, что циркулирующие концентрации экзосомальных miRNA-141 и miRNA-375 могут быть ценными биомаркерами для диагностики предстательной железы рак [83]. Наличие двух известных биомаркеров рака простаты, а именно PCA-3 и TMRPRSS2: ERG, было продемонстрировано в экзосомах в моче, собранных у пациентов с раком предстательной железы [84]. Было обнаружено, что концентрация экзосомальной miRNA-21 в сыворотке у пациентов с эзофагиальным плоскоклеточным раком (ESCC) по сравнению с сывороткой у пациентов с доброкачественными опухолями без системного воспаления, экзосомальная miRNA-21 также демонстрирует потенциал как биомаркеров для диагностики рак пищеводного рака [85]. Сообщалось также, что концентрация miRNA-1246 повышается в экзосомах, выделенных из образцов сыворотки пациентов с ESCC, она не была активирована в образцах ткани ESCC [86]. Этот вывод показывает, что циркулирующая экзосомальная miRNA-1246, но не биопсия-miRNA-1246, обладает значительным потенциалом в качестве нового диагностического и прогностического биомаркера в ESCC. В противном случае экзосомальные miRNAs также продемонстрировали высокий потенциал как диагностические биомаркеры для сердечно-сосудистых заболеваний и почечного фиброза [87,88]. Протеины сыворотки в экзосомах мочи, которые легко могут быть получены неинвазивными методами, также использовались для их потенциальной утилиты в диагностике, особенно при заболеваниях мочевыводящих путей.
Экзосомы как терапевтические инструменты
EV, которые, естественно, высвобождаются из определенных типов клеток, обладают потенциалом для использования в качестве терапевтических инструментов. Мезенхимальные стволовые клетки (MSC) -полученные EV пересказывают иммуномодулирующую и цитопротекторную активность их родительских клеток [93,94]. Экзосомы, индуцированные дендритными клетками человека, несущие H-Y пептид, вызывали наивные МАРРИН CD4 + трансгенные Т-клетки in vivo. Однако эти экзосомы были только иммуногенными, когда их инкубировали со зрелыми дендритными клетками, которые ранее не встречались с антигенами [16]. Экзосомы, индуцированные дендритными клетками человека (DEX), загруженные комплексом пептидов с основным комплексом гистосовместимости (MHC) класса I, активируют пептидспецифический клон CD8 + T-клеток только в присутствии дендритной клетки, лишенной надлежащего компонента I MHC [95,96]. Дендритные клетки человека продуцировали компетентный связанный с экзосомой комплекс МНС класса I, который был опытным в цитостатических Т-лимфоцитах в естественных условиях in vivo, но для процесса прайминга требовались зрелые дендритные клетки [95,97]. Экзосомы, полученные из MSC-костного мозга, были защитными в моделях миокардиальной ишемии / реперфузионной травмы [34], индуцированной гипоксией легочной гипертензии [98] и повреждения головного мозга [99, 100]. Эти экзосомы также стимулировали рост нейритов в культивируемых астроцитах путем переноса miR-133b между клетками [101]. Человеческие пуповины, полученные МСЦ, были защитными в моделях острой почечной недостаточности [102] и фиброзе печени [103]. Экзосомы, вызванные MSC, ингибировали рост рака молочной железы посредством снижения уровня эндотелиального фактора роста сосудов и передачи miR-16 у мышей [104]. Однако сообщалось о измененных функциях линий раковых клеток [105], ослаблении иммунного отторжения опухоли [106] и увеличении роста опухоли в результате лечения экзосом. Кроме того, аутоиммунты, индуцированные экзосом, индуцированные островком MSC у непереносимых диабетических мышей [107]. Экзосомы просты в обращении и могут быть легко применены для переноса белков и генов среди клеток. Эти характеристики экзосомы указывают на их потенциальные возможности для ингибирования патологического ангиогенеза и метастазов рака, которые являются двумя основными объектами терапии рака [108,109]. Более того, экзосомы обсуждались как потенциальные противораковые вакцины [110]. Цель иммунотерапии рака заключается в том, чтобы стимулировать иммунитет против опухоли или поддерживать постоянный иммунный ответ против опухолевого хозяина, который в противном случае неэффективен по таким причинам, как иммуносупрессия в микроокружении опухоли. Стратегии включают активацию дендритных клеток или их функций путем индуцирования связанных с опухолью-антиген-специфических Т-клеточных реакций. По имеющимся сообщениям, усыновленные переносы опухолесодержащих антиген-нагруженных зрелых аутологичных дендритных клеток увеличивают общую выживаемость у пациентов с метастатическим кантационно-устойчивым раком предстательной железы [111]. Уникальные характеристики экзосомы, включая их известный молекулярный состав и критическую иммуногенность, способствуют их производству с использованием процессов «хорошей производственной практики» (GMP), что позволяет проводить клинические испытания с использованием DEX у пациентов с метастатическими опухолями. Пятнадцать продвинутых (стадия III / IV) пациентов с меланомой с опухолями, несущими антиген MAGE-3, участвовали и провели первый этап исследования I по вопросу о целесообразности и безопасности введения DEX во Франции [75]. В этом исследовании DEX вводили подкожные / внутрикожные инъекции каждую неделю в течение первых 4 недель, затем каждые 3 недели после этого у пациентов, которые достигли стабильного заболевания или имели объективный ответ опухоли. Пациенты, которым вводили DEX 6-120 раз, показали резкое увеличение концентрации экзосомы в их кровообращении. График терапии контролировался хорошо, и не было никаких токсических реакций, превышающих NCI-CTC 2-го класса. Пять пациентов получили некоторые положительные клинические эффекты (один частичный, один незначительный, один смешанный ответ и два стабильных заболевания) на целевые поражения в кожных и лимфатических узлах , Два пациента, которым была назначена стандартная вакцинация MAGE-3, показали клинический ответ на лечение DEX [75]. После терапии экзосом T-клеточное иммуномониторинг обнаружило, что молекула CD122 (цепь β-рецептора интерлейкина-2) была активирована в CD4 + Т-клетках, но никаких серьезных изменений в других маркерах Т-клеток не обнаружено. В то время как пул лимфоцитов оставался стабильным на протяжении всей экзосомной терапии, после трех раундов вакцинации с экзосомами резко увеличилось количество циркулирующих клеток CD3 / CD56 + естественного киллера (NK). Было проведено клиническое испытание фазы II для оценки клинической пользы IFN-ν-DEX, содержащей MHC класса I и раковые антигены класса II в качестве стратегии иммунотерапии сохранения после индукционной химиотерапии у пациентов с неоперабельным немелкоклеточным раком легкого ( НМРЛ) без прогрессирования опухоли. Результаты показали увеличение NKp30-зависимых функций NK-клеток во фракции пациентов с НМРЛ, которые представили несовершенную экспрессию NKp30.
Примечательно, что уровни экспрессии MHC класса II конечных продуктов IFN-ν-DEX коррелировали с уровнями экспрессии лиганда NKp30 BAG6 на DEX и с NKp30-зависимыми функциями NK-клеток. Последний параметр также коррелировал с более продолжительной выживаемостью без прогрессирования. Таким образом, это исследование фазы II определило способность администрации DEX усилить реакцию NK-клеток противоопухолевого иммунитета у пациентов с продвинутым НМРЛ [112]. Фундаментальное лечение пациентов с продвинутым НМРЛ основано на четырех-шести циклах химиотерапии на основе дублетов на основе платины. Хотя качество жизни и выживание могут быть улучшены благодаря этому методу лечения по сравнению с наилучшим поддерживающим вниманием, токсичность остается серьезной проблемой, и различные стратегии лечения интенсивно изучаются [113]. В частности, различные исследовательские усилия были сосредоточены на расширении преимуществ первой линии химиотерапии, которая определяется как стратегия «поддержания». На сегодняшний день утвержденная терапия включает в себя пролонгирование одного или нескольких препаратов, используемых в индукционном режиме (продолжение обслуживания) или применение другого режима без перекрестной резистентности (переключение или ранняя терапия второй линии) [114 ]. После испытаний I фазы DEX были исследованы инновационные методы разработки DEX в качестве иммунотерапии с целью дальнейшего улучшения частичных DEX-индуцированных Т-клеточных реакций. Использование экзосом, полученных из TLR4L- или IFN-ν-созревших дендритных клеток, вызывает большую стимуляцию Т-клеток, чем незрелая дендритная клеточная индуцированная экзосома, и этот метод был важным новшеством в терапевтическом применении экзосомы [115,116,117]. Экзосомы из опухолевых клеток стимулируют иммуносупрессию посредством промотирования апоптоза Т-клеток, подавления дифференцировки дендритных клеток и цитотоксичности NK и стимуляции иммуносупрессивных миелоидных супрессорных клеток и регуляторных Т-клеток [118]. Некоторые ситуации, такие как тепловые и окислительные стрессы, могут усилить выделение иммуносупрессивных экзосом из лейкозов и лимфомы Т и В-клеток [119] и способствовать изменениям протеомического и генетического содержания экзосомы, которые влияют на ответы клеток-реципиентов на сигналы напряжения ( Фиг.4) [120, 121].
Экзосомы как инструменты доставки лекарств
Экзосомы могут использоваться в качестве целевых систем доставки лекарств. Экзосомы, полученные из незрелой дендритной клетки из костного мозга мыши, были нагружены стимулирующими молекулами, такими как MHCII и CD80 [76]. Экзосомы, очищенные ультрацентрифугированием, использовались в качестве носителя для доставки коротких мешающих РНК (siRNA) как в исследованиях in vitro, так и in vivo. В этих исследованиях выбран мозг как ткань-мишень, поскольку считается, что гематоэнцефалический барьер представляет собой препятствие для доставки лекарств в ЦНС. Гематоэнцефалический барьер представляет собой препятствие для доставки лекарств, поскольку он состоит из капиллярных эндотелиальных клеток, которые плотно запечатаны межклеточными соединениями и регулируют барьерные функции [43]. Экзосомы несут естественные РНК через гематоэнцефалический барьер и могут обеспечить эффективные методы доставки. В некоторых исследованиях была предложена концепция использования экзосомы для систем нуклеиновой кислоты или доставки лекарств, которые продемонстрировали перенос внутриклеточных мРНК и miRNAs из клеток, продуцирующих экзосомы, в другие культивируемые клетки [22,33]. Кроме того, JS1124, который является ингибитором сигнального преобразователя и активатора транскрипционных белков и куркумина, успешно переносится в клетки микроглии через интраназальный путь у мышей [122]. Лекарственные экзосомы избирательно поглощались клетками микроглии и позже индуцировали их апоптоз после интраназальной доставки экзосом у мышей [122]. Чтобы обеспечить целенаправленную доставку экзосом, была использована инновационная стратегия использования LAMP2B, которая представляет собой поверхностный белок экзосомальной мембраны, для отображения целевого пептида на поверхностях экзосомы. Возможность использования экзосом для доставки siRNA была доказана сильным мРНК (60%) и белком (62%) нокдауна BACE1, который является терапевтической мишенью при болезни Альцгеймера у мышей дикого типа [123]. Для клинического применения этого метода потребуется источник «собственных» экзосом, а также технические возможности для загрузки их терапевтическими агентами, такими как химически модифицированные siRNAs, и инженерами с соответствующими целевыми группами [123]. Клетки млекопитающих активно секретируют экзосомы с диаметром 40-150 нм и содержат различные белки и РНК со многими регуляторными функциями, которые могут модифицировать фенотипы клеток-реципиентов [124, 125]. Поскольку наноразмерные экзосомы могут переносить молекулы клеточной поверхности, они обладают не только высокой способностью проникать в междоузельную ткань органов, но и обладают естественной способностью к таргетингу [123, 126, 127]. Несмотря на эти преимущества, большинство клеток млекопитающих выделяют относительно низкое количество экзосом, и это проблема очистки экзосом при достаточно высоком урожае [128]. Таким образом, производство наноразмерных искусственных экзосомы-имитирующих везикул с существенно большим выходом является привлекательной методологией для разработки систем доставки лекарств на основе экзосомы [129]. Новые разработанные нанокристаллические нановолоконы, полученные на основе биоиндустрии, которые называются экзосомально-миметическими нанопузырями, объединяют характеристики клеток и нановолокон и могут быть применены для целенаправленной доставки противоопухолевых препаратов. Обращаясь к клеткам разного происхождения к серийной экструзии через фильтры с уменьшающимися размерами пор после загрузки клеток химиотерапевтическими агентами, было создано большое количество экзосомально-миметических нанопузыжек, содержащих защищенные лекарственные средства с 100-кратным увеличением выхода продукции. Кроме того, была продемонстрирована эффективная и дозозависимая доставка химиотерапевтических агентов в клетки и ткани с использованием этих экзосом. Таким образом, эти биоинжинированные нанонасышки с лекарственным средством могут служить в качестве новых экзосомных миметиков для эффективного доставки химиотерапевтических агентов для лечения злокачественных опухолей [129].
ЗАКЛЮЧЕНИЕ
Таким образом, хорошо известно, что большинство типов клеток, особенно раковые клетки, выделяют экзосомы во внеклеточные пространства и обнаруживают их в различных биологических жидкостях. Мы описали формирование, структуру и физиологическую роль экзосом. Мы также обсуждаем их роли в патогенезе и прогрессировании заболеваний, включая нейродегенеративные заболевания, сердечно-сосудистые заболевания и рак, а также потенциальное применение экзосом для терапевтических целей при различных заболеваниях. В этом обзоре обобщаются текущие знания о физиологических и патологических ролях экзосом, а также их диагностических и терапевтических целях, в том числе возникающие на основе экзосомы методы лечения и система доставки лекарств, имитирующих экзосома, которые до сих пор не могли быть применены.
СПИСОК ЛИТЕРАТУРЫ
1. van der Pol E, Böing AN, Harrison P, Sturk A, Nieuwland R. Classification, functions, and clinical relevance of extracellular vesicles. Pharmacol Rev. 2012;64:676–705. [PubMed]
2. Kalra H, Drummen GP, Mathivanan S. Focus on extracellular vesicles: introducing the next small big thing. Int J Mol Sci. 2016;17:170. [PMC free article] [PubMed]
3. Zaborowski MP, Balaj L, Breakefield XO, Lai CP. Extracellular vesicles: composition, biological relevance, and methods of study. Bioscience. 2015;65:783–797. [PMC free article] [PubMed]
4. Hurley JH. ESCRTs are everywhere. EMBO J. 2015;34:2398–2407. [PMC free article] [PubMed]
5. Huotari J, Helenius A. Endosome maturation. EMBO J. 2011;30:3481–3500. [PMC free article][PubMed]
6. Xu W, Zeng S, Li M, Fan Z, Zhou B. Aggf1 attenuates hepatic inflammation and activation of hepatic stellate cells by repressing Ccl2 transcription. J Biomed Res. 2016;31:1–9. [PubMed]
7. Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes. Curr Opin Cell Biol. 2014;29:116–125. [PubMed]
8. Henne WM, Buchkovich NJ, Emr SD. The ESCRT pathway. Dev Cell. 2011;21:77–91. [PubMed]
9. McGough IJ, Vincent JP. Exosomes in developmental signalling. Development. 2016;143:2482–2493.[PubMed]
10. Baietti MF, Zhang Z, Mortier E, Melchior A, Degeest G, Geeraerts A, Ivarsson Y, Depoortere F, Coomans C, Vermeiren E, Zimmermann P, David G. Syndecan-syntenin-ALIX regulates the biogenesis of exosomes. Nat Cell Biol. 2012;14:677–685. [PubMed]
11. Andreu Z, Yáñez-Mó M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 2014;5:442. [PMC free article] [PubMed]
12. Yuyama K, Igarashi Y. Physiological and pathological roles of exosomes in the nervous system. Biomol Concepts. 2016;7:53–68. [PubMed]
13. Madison MN, Okeoma CM. Exosomes: implications in HIV-1 pathogenesis. Viruses. 2015;7:4093–4118. [PMC free article] [PubMed]
14. Peterson MF, Otoc N, Sethi JK, Gupta A, Antes TJ. Integrated systems for exosome investigation. Methods. 2015;87:31–45. [PubMed]
15. EL Andaloussi S, Mäger I, Breakefield XO, Wood MJ. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 2013;12:347–357. [PubMed]
16. Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2:569–579. [PubMed]
17. Andre F, Schartz NE, Movassagh M, Flament C, Pautier P, Morice P, Pomel C, Lhomme C, Escudier B, Le Chevalier T, Tursz T, Amigorena S, Raposo G, Angevin E, Zitvogel L. Malignant effusions and immunogenic tumour-derived exosomes. Lancet. 2002;360:295–305. [PubMed]
18. Hendrix A, Westbroek W, Bracke M, De Wever O. An ex(o)citing machinery for invasive tumor growth. Cancer Res. 2010;70:9533–9537. [PubMed]
19. Zwicker JI, Liebman HA, Neuberg D, Lacroix R, Bauer KA, Furie BC, Furie B. Tumor-derived tissue factor-bearing microparticles are associated with venous thromboembolic events in malignancy. Clin Cancer Res. 2009;15:6830–6840. [PMC free article] [PubMed]
20. Barry OP, Praticò D, Savani RC, FitzGerald GA. Modulation of monocyte-endothelial cell interactions by platelet microparticles. J Clin Invest. 1998;102:136–144. [PMC free article] [PubMed]
21. Parolini I, Federici C, Raggi C, Lugini L, Palleschi S, De Milito A, Coscia C, Iessi E, Logozzi M, Molinari A, Colone M, Tatti M, Sargiacomo M, Fais S. Microenvironmental pH is a key factor for exosome traffic in tumor cells. J Biol Chem. 2009;284:34211–34222. [PMC free article] [PubMed]
22. Skog J, Würdinger T, van Rijn S, Meijer DH, Gainche L, Sena-Esteves M, Curry WT, Jr, Carter BS, Krichevsky AM, Breakefield XO. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat Cell Biol. 2008;10:1470–1476. [PMC free article][PubMed]
23. Villarroya-Beltri C, Baixauli F, Gutiérrez-Vázquez C, Sánchez-Madrid F, Mittelbrunn M. Sorting it out: regulation of exosome loading. Semin Cancer Biol. 2014;28:3–13. [PMC free article] [PubMed]
24. de Jong OG, Verhaar MC, Chen Y, Vader P, Gremmels H, Posthuma G, Schiffelers RM, Gucek M, van Balkom BW. Cellular stress conditions are reflected in the protein and RNA content of endothelial cell-derived exosomes. J Extracell Vesicles. 2012;1:18396. doi: 10.3402/jev.v1i0.18396. [PMC free article][PubMed] [Cross Ref]
25. Grange C, Tapparo M, Collino F, Vitillo L, Damasco C, Deregibus MC, Tetta C, Bussolati B, Camussi G. Microvesicles released from human renal cancer stem cells stimulate angiogenesis and formation of lung premetastatic niche. Cancer Res. 2011;71:5346–5356. [PubMed]
26. Peinado H, Alečkovič M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, García-Santos G, Ghajar C, Nitadori-Hoshino A, Hoffman C, Badal K, Garcia BA, Callahan MK, Yuan J, Martins VR, Skog J, Kaplan RN, Brady MS, Wolchok JD, Chapman PB, Kang Y, Bromberg J, Lyden D. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat Med. 2012;18:883–891. [PMC free article] [PubMed]
27. Wieckowski EU, Visus C, Szajnik M, Szczepanski MJ, Storkus WJ, Whiteside TL. Tumor-derived microvesicles promote regulatory T cell expansion and induce apoptosis in tumor-reactive activated CD8+ T lymphocytes. J Immunol. 2009;183:3720–3730. [PMC free article] [PubMed]
28. Szajnik M, Czystowska M, Szczepanski MJ, Mandapathil M, Whiteside TL. Tumor-derived microvesicles induce, expand and upregulate biological activities of human regulatory T cells (Treg) PLoS One. 2010;5:e11469 [PMC free article] [PubMed]
29. Segura E, Guérin C, Hogg N, Amigorena S, Théry C. CD8+ dendritic cells use LFA-1 to capture MHC-peptide complexes from exosomes in vivo. J Immunol. 2007;179:1489–1496. [PubMed]
30. Morelli AE, Larregina AT, Shufesky WJ, Sullivan ML, Stolz DB, Papworth GD, Zahorchak AF, Logar AJ, Wang Z, Watkins SC, Falo LD, Jr, Thomson AW. Endocytosis, intracellular sorting, and processing of exosomes by dendritic cells. Blood. 2004;104:3257–3266. [PubMed]
31. Fitzner D, Schnaars M, van Rossum D, Krishnamoorthy G, Dibaj P, Bakhti M, Regen T, Hanisch UK, Simons M. Selective transfer of exosomes from oligodendrocytes to microglia by macropinocytosis. J Cell Sci. 2011;124:447–458. [PubMed]
32. Théry C, Boussac M, Véron P, Ricciardi-Castagnoli P, Raposo G, Garin J, Amigorena S. Proteomic analysis of dendritic cell-derived exosomes: a secreted subcellular compartment distinct from apoptotic vesicles. J Immunol. 2001;166:7309–7318. [PubMed]
33. Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007;9:654–659. [PubMed]
34. Lai RC, Arslan F, Lee MM, Sze NS, Choo A, Chen TS, Salto-Tellez M, Timmers L, Lee CN, El Oakley RM, Pasterkamp G, de Kleijn DP, Lim SK. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010;4:214–222. [PubMed]
35. Bobrie A, Théry C. Unraveling the physiological functions of exosome secretion by tumors. Oncoimmunology. 2013;2:e22565 [PMC free article] [PubMed]
36. Cocucci E, Racchetti G, Meldolesi J. Shedding microvesicles: artefacts no more. Trends Cell Biol. 2009;19:43–51. [PubMed]
37. Crescitelli R, Lässer C, Szabó TG, Kittel A, Eldh M, Dianzani I, Buzás EI, Lötvall J. Distinct RNA profiles in subpopulations of extracellular vesicles: apoptotic bodies, microvesicles and exosomes. J Extracell Vesicles. 2013;2 doi: 10.3402/jev.v2i0.20677. [PMC free article] [PubMed] [Cross Ref]
38. Montecalvo A, Larregina AT, Shufesky WJ, Stolz DB, Sullivan ML, Karlsson JM, Baty CJ, Gibson GA, Erdos G, Wang Z, Milosevic J, Tkacheva OA, Divito SJ, Jordan R, Lyons-Weiler J, Watkins SC, Morelli AE. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 2012;119:756–766. [PMC free article] [PubMed]
39. Li J, Zhang Y, Liu Y, Dai X, Li W, Cai X, Yin Y, Wang Q, Xue Y, Wang C, Li D, Hou D, Jiang X, Zhang J, Zen K, Chen X, Zhang CY. Microvesicle-mediated transfer of microRNA-150 from monocytes to endothelial cells promotes angiogenesis. J Biol Chem. 2013;288:23586–23596. [PMC free article][PubMed]
40. Skinner AM, O'Neill SL, Kurre P. Cellular microvesicle pathways can be targeted to transfer genetic information between non-immune cells. PLoS One. 2009;4:e6219 [PMC free article] [PubMed]
41. Hannafon BN, Ding WQ. Intercellular communication by exosome-derived microRNAs in cancer. Int J Mol Sci. 2013;14:14240–14269. [PMC free article] [PubMed]
42. Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol. 2013;200:373–383. [PMC free article] [PubMed]
43. Ahmad M, Iqbal M, Akhtar N, Murtaza G, Madni MA, Rasool F. Comparison of bioavailability and pharmacokinetics of diclofenac sodium and diclofenac potassium in healthy and Escherichia coli induced febrile rabbits. Pakistan J Zool. 2010;42:395–400.
44. Hoebe K, Janssen E, Beutler B. The interface between innate and adaptive immunity. Nat Immunol. 2004;5:971–974. [PubMed]
45. Tanaka M, Oikawa K, Takanashi M, Kudo M, Ohyashiki J, Ohyashiki K, Kuroda M. Down-regulation of miR-92 in human plasma is a novel marker for acute leukemia patients. PLoS One. 2009;4:e5532[PMC free article] [PubMed]
46. Tan M, Yan HB, Li JN, Li WK, Fu YY, Chen W, Zhou Z. Thrombin stimulated platelet-derived exosomes inhibit platelet-derived growth factor receptor-beta expression in vascular smooth muscle cells. Cell Physiol Biochem. 2016;38:2348–2365. [PubMed]
47. Khiljee S, Ahmad M, Murtaza G, Madni A, Akhtar N, Akhtar M. Bioequivalence evaluation of norfloxacin tablets based on in vitro - in vivo correlation. Pak J Pharm Sci. 2011;24:421–426. [PubMed]
48. Raposo G, Nijman HW, Stoorvogel W, Liejendekker R, Harding CV, Melief CJ, Geuze HJ. B lymphocytes secrete antigen-presenting vesicles. J Exp Med. 1996;183:1161–1172. [PMC free article][PubMed]
49. Mittelbrunn M, Gutiérrez-Vázquez C, Villarroya-Beltri C, González S, Sánchez-Cabo F, González MÁ, Bernad A, Sánchez-Madrid F. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nat Commun. 2011;2:282. [PMC free article] [PubMed]
50. Yang C, Robbins PD. The roles of tumor-derived exosomes in cancer pathogenesis. Clin Dev Immunol. 2011;2011:842849. [PMC free article] [PubMed]
51. Ahmad M, Ahmad R, Murtaza G. Comparative bioavailability and pharmacokinetics of flurbiprofen 200 mg SR pellets from India and France. Adv Clin Exp Med. 2011;20:599–604.
52. Zhang HG, Grizzle WE. Exosomes: a novel pathway of local and distant intercellular communication that facilitates the growth and metastasis of neoplastic lesions. Am J Pathol. 2014;184:28–41.[PMC free article] [PubMed]
53. Schorey JS, Cheng Y, Singh PP, Smith VL. Exosomes and other extracellular vesicles in host-pathogen interactions. EMBO Rep. 2015;16:24–43. [PMC free article] [PubMed]
54. El Andaloussi S, Lakhal S, Mäger I, Wood MJ. Exosomes for targeted siRNA delivery across biological barriers. Adv Drug Deliv Rev. 2013;65:391–397. [PubMed]
55. Howitt J, Hill AF. Exosomes in the pathology of neurodegenerative diseases. J Biol Chem. 2016;291:26589–26597. [PMC free article] [PubMed]
56. Lakhter AJ, Sims EK. Minireview: emerging roles for extracellular vesicles in diabetes and related metabolic disorders. Mol Endocrinol. 2015;29:1535–1548. [PMC free article] [PubMed]
57. Stepanian A, Bourguignat L, Hennou S, Coupaye M, Hajage D, Salomon L, Alessi MC, Msika S, de Prost D. Microparticle increase in severe obesity: not related to metabolic syndrome and unchanged after massive weight loss. Obesity (Silver Spring) 2013;21:2236–2243. [PubMed]
58. Cheng V, Kashyap SR, Schauer PR, Kirwan JP, McCrae KR. Restoration of glycemic control in patients with type 2 diabetes mellitus after bariatric surgery is associated with reduction in microparticles. Surg Obes Relat Dis. 2013;9:207–212. [PMC free article] [PubMed]
59. Suades R, Padró T, Badimon L. The role of blood-borne microparticles in inflammation and hemostasis. Semin Thromb Hemost. 2015;41:590–606. [PubMed]
60. Amabile N, Cheng S, Renard JM, Larson MG, Ghorbani A, Mc-Cabe E, Griffin G, Guerin C, Ho JE, Shaw SY, Cohen KS, Vasan RS, Tedgui A, Boulanger CM, Wang TJ. Association of circulating endothelial microparticles with cardiometabolic risk factors in the Framingham Heart Study. Eur Heart J. 2014;35:2972–2979. [PMC free article] [PubMed]
61. Lawson C, Vicencio JM, Yellon DM, Davidson SM. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. J Endocrinol. 2016;228:R57–R71. [PubMed]
62. Yang C, Robbins PD. Immunosuppressive exosomes: a new approach for treating arthritis. Int J Rheumatol. 2012;2012:573528. [PMC free article] [PubMed]
63. Tran TH, Nguyen HT, Pham TT, Choi JY, Choi HG, Yong CS, Kim JO. Development of a graphene oxide nanocarrier for dual-drug chemo-phototherapy to overcome drug resistance in cancer. ACS Appl Mater Interface. 2015;7:28647–28655. [PubMed]
64. Pisitkun T, Johnstone R, Knepper MA. Discovery of urinary biomarkers. Mol Cell Proteomics. 2006;5:1760–1771. [PubMed]
65. Simpson RJ, Lim JW, Moritz RL, Mathivanan S. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics. 2009;6:267–283. [PubMed]
66. Runz S, Keller S, Rupp C, Stoeck A, Issa Y, Koensgen D, Mustea A, Sehouli J, Kristiansen G, Altevogt P. Malignant ascites-derived exosomes of ovarian carcinoma patients contain CD24 and EpCAM. Gynecol Oncol. 2007;107:563–571. [PubMed]
67. Lässer C, Alikhani VS, Ekström K, Eldh M, Paredes PT, Bossios A, Sjöstrand M, Gabrielsson S, Lötvall J, Valadi H. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. J Transl Med. 2011;9:9. [PMC free article] [PubMed]
68. Keller S, Rupp C, Stoeck A, Runz S, Fogel M, Lugert S, Hager HD, Abdel-Bakky MS, Gutwein P, Altevogt P. CD24 is a marker of exosomes secreted into urine and amniotic fluid. Kidney Int. 2007;72:1095–1102. [PubMed]
69. Taylor DD, Homesley HD, Doellgast GJ. “Membrane-associated” immunoglobulins in cyst and ascites fluids of ovarian cancer patients. Am J Reprod Immunol. 1983;3:7–11. [PubMed]
70. Logozzi M, De Milito A, Lugini L, Borghi M, Calabrò L, Spada M, Perdicchio M, Marino ML, Federici C, Iessi E, Brambilla D, Venturi G, Lozupone F, Santinami M, Huber V, Maio M, Rivoltini L, Fais S. High levels of exosomes expressing CD63 and caveolin-1 in plasma of melanoma patients. PLoS One. 2009;4:e5219 [PMC free article] [PubMed]
71. Mathivanan S, Ji H, Simpson RJ. Exosomes: extracellular organelles important in intercellular communication. J Proteomics. 2010;73:1907–1920. [PubMed]
72. Qu JL, Qu XJ, Zhao MF, Teng YE, Zhang Y, Hou KZ, Jiang YH, Yang XH, Liu YP. Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation. Dig Liver Dis. 2009;41:875–880. [PubMed]
73. McCready J, Sims JD, Chan D, Jay DG. Secretion of extracellular hsp90alpha via exosomes increases cancer cell motility: a role for plasminogen activation. BMC Cancer. 2010;10:294. [PMC free article][PubMed]
74. Jung T, Catalgol B, Grune T. The proteasomal system. Mol Aspects Med. 2009;30:191–296. [PubMed]
75. Lamparski HG, Metha-Damani A, Yao JY, Patel S, Hsu DH, Ruegg C, Le Pecq JB. Production and characterization of clinical grade exosomes derived from dendritic cells. J Immunol Methods. 2002;270:211–226. [PubMed]
76. Morse MA, Garst J, Osada T, Khan S, Hobeika A, Clay TM, Valente N, Shreeniwas R, Sutton MA, Delcayre A, Hsu DH, Le Pecq JB, Lyerly HK. A phase I study of dexosome immunotherapy in patients with advanced non-small cell lung cancer. J Transl Med. 2005;3:9. [PMC free article] [PubMed]
77. Yoshioka Y, Konishi Y, Kosaka N, Katsuda T, Kato T, Ochiya T. Comparative marker analysis of extracellular vesicles in different human cancer types. J Extracell Vesicles. 2013;2 doi: 10.3402/jev.v2i0.20424. [PMC free article] [PubMed] [Cross Ref]
78. Smalley DM, Sheman NE, Nelson K, Theodorescu D. Isolation and identification of potential urinary microparticle biomarkers of bladder cancer. J Proteome Res. 2008;7:2088–2096. [PubMed]
79. Chen CL, Lai YF, Tang P, Chien KY, Yu JS, Tsai CH, Chen HW, Wu CC, Chung T, Hsu CW, Chen CD, Chang YS, Chang PL, Chen YT. Comparative and targeted proteomic analyses of urinary microparticles from bladder cancer and hernia patients. J Proteome Res. 2012;11:5611–5629. [PubMed]
80. Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A, Lin DW, Urban N, Drescher CW, Knudsen BS, Stirewalt DL, Gentleman R, Vessella RL, Nelson PS, Martin DB, Tewari M. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A. 2008;105:10513–10518. [PMC free article][PubMed]
81. Brase JC, Johannes M, Schlomm T, Fälth M, Haese A, Steuber T, Beissbarth T, Kuner R, Sültmann H. Circulating miRNAs are correlated with tumor progression in prostate cancer. Int J Cancer. 2011;128:608–616. [PubMed]
82. Hunter MP, Ismail N, Zhang X, Aguda BD, Lee EJ, Yu L, Xiao T, Schafer J, Lee ML, Schmittgen TD, Nana-Sinkam SP, Jarjoura D, Marsh CB. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One. 2008;3:e3694 [PMC free article] [PubMed]
83. Lin J, Li J, Huang B, Liu J, Chen X, Chen XM, Xu YM, Huang LF, Wang XZ. Exosomes: novel biomarkers for clinical diagnosis. ScientificWorldJournal. 2015;2015 [PMC free article] [PubMed]
84. Nilsson J, Skog J, Nordstrand A, Baranov V, Mincheva-Nilsson L, Breakefield XO, Widmark A. Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer. Br J Cancer. 2009;100:1603–1607. [PMC free article] [PubMed]
85. Tanaka Y, Kamohara H, Kinoshita K, Kurashige J, Ishimoto T, Iwatsuki M, Watanabe M, Baba H. Clinical impact of serum exosomal microRNA-21 as a clinical biomarker in human esophageal squamous cell carcinoma. Cancer. 2013;119:1159–1167. [PubMed]
86. Takeshita N, Hoshino I, Mori M, Akutsu Y, Hanari N, Yoneyama Y, Ikeda N, Isozaki Y, Maruyama T, Akanuma N, Komatsu A, Jitsukawa M, Matsubara H. Serum microRNA expression profile: miR-1246 as a novel diagnostic and prognostic biomarker for oesophageal squamous cell carcinoma. Br J Cancer. 2013;108:644–652. [PMC free article] [PubMed]
87. Kuwabara Y, Ono K, Horie T, Nishi H, Nagao K, Kinoshita M, Watanabe S, Baba O, Kojima Y, Shizuta S, Imai M, Tamura T, Kita T, Kimura T. Increased microRNA-1 and microRNA-133a levels in serum of patients with cardiovascular disease indicate myocardial damage. Circ Cardiovasc Genet. 2011;4:446–454.[PubMed]
88. Lv LL, Cao YH, Ni HF, Xu M, Liu D, Liu H, Chen PS, Liu BC. MicroRNA-29c in urinary exosome/microvesicle as a biomarker of renal fibrosis. Am J Physiol Renal Physiol. 2013;305:F1220–F1227. [PubMed]
89. Zhou H, Yuen PS, Pisitkun T, Gonzales PA, Yasuda H, Dear JW, Gross P, Knepper MA, Star RA. Collection, storage, preservation, and normalization of human urinary exosomes for biomarker discovery. Kidney Int. 2006;69:1471–1476. [PMC free article] [PubMed]
90. Zhou H, Xu M, Huang Q, Gates AT, Zhang XD, Castle JC, Stec E, Ferrer M, Strulovici B, Hazuda DJ, Espeseth AS. Genome-scale RNAi screen for host factors required for HIV replication. Cell Host Microbe. 2008;4:495–504. [PubMed]
91. Takata K, Matsuzaki T, Tajika Y, Ablimit A, Hasegawa T. Localization and trafficking of aquaporin 2 in the kidney. Histochem Cell Biol. 2008;130:197–209. [PMC free article] [PubMed]
92. Palanisamy V, Sharma S, Deshpande A, Zhou H, Gimzewski J, Wong DT. Nanostructural and transcriptomic analyses of human saliva derived exosomes. PLoS One. 2010;5:e8577 [PMC free article][PubMed]
93. Baglio SR, Pegtel DM, Baldini N. Mesenchymal stem cell secreted vesicles provide novel opportunities in (stem) cell-free therapy. Front Physiol. 2012;3:359. [PMC free article] [PubMed]
94. Chen TS, Yeo RWY, Arslan F, Yin Y, Tan SS, Lai RC, Choo A, Padmanabhan J, Lee CN, de Kleijn DPV, Tan KH, Lim SK. Efficiency of exosome production correlates inversely with the developmental maturity of MSC donor. J Stem Cell Res Ther. 2013;3:145.
95. André F, Chaput N, Schartz NE, Flament C, Aubert N, Bernard J, Lemonnier F, Raposo G, Escudier B, Hsu DH, Tursz T, Amigorena S, Angevin E, Zitvogel L. Exosomes as potent cell-free peptide-based vaccine. I. Dendritic cell-derived exosomes transfer functional MHC class I/peptide complexes to dendritic cells. J Immunol. 2004;172:2126–2136. [PubMed]
96. Hsu DH, Paz P, Villaflor G, Rivas A, Mehta-Damani A, Angevin E, Zitvogel L, Le Pecq JB. Exosomes as a tumor vaccine: enhancing potency through direct loading of antigenic peptides. J Immunother. 2003;26:440–450. [PubMed]
97. Chaput N, Schartz NE, André F, Taïeb J, Novault S, Bonnaventure P, Aubert N, Bernard J, Adema G, Adams M, Ferrantini M, Carpentier AF, Escudier B, Tursz T, Angevin E, Zitvogel L. Exosomes as potent cell-free peptide-based vaccine. II. Exosomes in CpG adjuvants efficiently prime naive Tc1 lymphocytes leading to tumor rejection. J Immunol. 2004;172:2137–2146. [PubMed]
98. Lee C, Mitsialis SA, Aslam M, Vitali SH, Vergadi E, Konstantinou G, Sdrimas K, Fernandez-Gonzalez A, Kourembanas S. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension. Circulation. 2012;126:2601–2611. [PMC free article] [PubMed]
99. Doeppner TR, Herz J, Görgens A, Schlechter J, Ludwig AK, Radtke S, de Miroschedji K, Horn PA, Giebel B, Hermann DM. Extracellular vesicles improve post-stroke neuroregeneration and prevent postischemic immunosuppression. Stem Cells Transl Med. 2015;4:1131–1143. [PMC free article][PubMed]
100. Zhang Y, Chopp M, Meng Y, Katakowski M, Xin H, Mahmood A, Xiong Y. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury. J Neurosurg. 2015;122:856–867. [PMC free article] [PubMed]
101. Xin H, Li Y, Buller B, Katakowski M, Zhang Y, Wang X, Shang X, Zhang ZG, Chopp M. Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth. Stem Cells. 2012;30:1556–1564. [PMC free article] [PubMed]
102. Bruno S, Grange C, Deregibus MC, Calogero RA, Saviozzi S, Collino F, Morando L, Busca A, Falda M, Bussolati B, Tetta C, Camussi G. Mesenchymal stem cell-derived microvesicles protect against acute tubular injury. J Am Soc Nephrol. 2009;20:1053–1067. [PMC free article] [PubMed]
103. Li T, Zhu J, Ma K, Liu N, Feng K, Li X, Wang S, Bie P. Autologous bone marrow-derived mesenchymal stem cell transplantation promotes liver regeneration after portal vein embolization in cirrhotic rats. J Surg Res. 2013;184:1161–1173. [PubMed]
104. Lee JK, Park SR, Jung BK, Jeon YK, Lee YS, Kim MK, Kim YG, Jang JY, Kim CW. Exosomes derived from mesenchymal stem cells suppress angiogenesis by down-regulating VEGF expression in breast cancer cells. PLoS One. 2013;8:e84256 [PMC free article] [PubMed]
105. Yang Y, Bucan V, Baehre H, von der, Otte A, Hass R. Acquisition of new tumor cell properties by MSC-derived exosomes. Int J Oncol. 2015;47:244–252. [PubMed]
106. Kordelas L, Rebmann V, Ludwig AK, Radtke S, Ruesing J, Doeppner TR, Epple M, Horn PA, Beelen DW, Giebel B. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 2014;28:970–973. [PubMed]
107. Rahman MJ, Regn D, Bashratyan R, Dai YD. Exosomes released by islet-derived mesenchymal stem cells trigger autoimmune responses in NOD mice. Diabetes. 2014;63:1008–1020. [PMC free article][PubMed]
108. Zöller M. Tetraspanins: push and pull in suppressing and promoting metastasis. Nat Rev Cancer. 2009;9:40–55. [PubMed]
109. Pap E, Pállinger E, Pásztói M, Falus A. Highlights of a new type of intercellular communication: microvesicle-based information transfer. Inflamm Res. 2009;58:1–8. [PubMed]
110. Taylor DD, Gercel-Taylor C. Exosomes/microvesicles: mediators of cancer-associated immunosuppressive microenvironments. Semin Immunopathol. 2011;33:441–454. [PubMed]
111. Kantoff PW, Higano CS, Shore ND, Berger ER, Small EJ, Penson DF, Redfern CH, Ferrari AC, Dreicer R, Sims RB, Xu Y, Frohlich MW, Schellhammer PF IMPACT Study Investigators. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med. 2010;363:411–422. [PubMed]
112. Besse B, Charrier M, Lapierre V, Dansin E, Lantz O, Planchard D, Le Chevalier T, Livartoski A, Barlesi F, Laplanche A, Ploix S, Vimond N, Peguillet I, Théry C, Lacroix L, Zoernig I, Dhodapkar K, Dhodapkar M, Viaud S, Soria JC, Reiners KS, Pogge von, Vély F, Rusakiewicz S, Eggermont A, Pitt JM, Zitvogel L, Chaput N. Dendritic cell-derived exosomes as maintenance immunotherapy after first line chemotherapy in NSCLC. Oncoimmunology. 2015;5:e1071008 [PMC free article] [PubMed]
113. Pignon JP, Tribodet H, Scagliotti GV, Douillard JY, Shepherd FA, Stephens RJ, Dunant A, Torri V, Rosell R, Seymour L, Spiro SG, Rolland E, Fossati R, Aubert D, Ding K, Waller D, Le Chevalier T LACE Collaborative Group. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26:3552–3559. [PubMed]
114. Polo V, Garcia-Martin E, Bambo MP, Pinilla J, Larrosa JM, Satue M, Otin S, Pablo LE. Reliability and validity of Cirrus and Spectralis optical coherence tomography for detecting retinal atrophy in Alzheimer's disease. Eye (Lond) 2014;28:680–690. [PMC free article] [PubMed]
115. Segura E, Nicco C, Lombard B, Véron P, Raposo G, Batteux F, Amigorena S, Théry C. ICAM-1 on exosomes from mature dendritic cells is critical for efficient naive T-cell priming. Blood. 2005;106:216–223. [PubMed]
116. Utsugi-Kobukai S, Fujimaki H, Hotta C, Nakazawa M, Minami M. MHC class I-mediated exogenous antigen presentation by exosomes secreted from immature and mature bone marrow derived dendritic cells. Immunol Lett. 2003;89:125–131. [PubMed]
117. Viaud S, Ploix S, Lapierre V, Théry C, Commere PH, Tramalloni D, Gorrichon K, Virault-Rocroy P, Tursz T, Lantz O, Zitvogel L, Chaput N. Updated technology to produce highly immunogenic dendritic cell-derived exosomes of clinical grade: a critical role of interferon-γ J Immunother. 2011;34:65–75.[PubMed]
118. Gutiérrez-Vázquez C, Villarroya-Beltri C, Mittelbrunn M, Sánchez-Madrid F. Transfer of extracellular vesicles during immune cell-cell interactions. Immunol Rev. 2013;251:125–142. [PMC free article][PubMed]
119. Hedlund M, Nagaeva O, Kargl D, Baranov V, Mincheva-Nilsson L. Thermal- and oxidative stress causes enhanced release of NKG2D ligand-bearing immunosuppressive exosomes in leukemia/lymphoma T and B cells. PLoS One. 2011;6:e16899 [PMC free article] [PubMed]
120. Biasutto L, Chiechi A, Couch R, Liotta LA, Espina V. Retinal pigment epithelium (RPE) exosomes contain signaling phosphoproteins affected by oxidative stress. Exp Cell Res. 2013;319:2113–2123.[PMC free article] [PubMed]
121. Eldh M, Ekström K, Valadi H, Sjöstrand M, Olsson B, Jernås M, Lötvall J. Exosomes communicate protective messages during oxidative stress; possible role of exosomal shuttle RNA. PLoS One. 2010;5:e15353 [PMC free article] [PubMed]
122. Zhang Y, Luo CL, He BC, Zhang JM, Cheng G, Wu XH. Exosomes derived from IL-12-anchored renal cancer cells increase induction of specific antitumor response in vitro: a novel vaccine for renal cell carcinoma. Int J Oncol. 2010;36:133–140. [PubMed]
123. Alvarez-Erviti L, Seow Y, Yin H, Betts C, Lakhal S, Wood MJ. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 2011;29:341–345. [PubMed]
124. Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 2009;9:581–593. [PubMed]
125. Sharma S, Kelly TK, Jones PA. Epigenetics in cancer. Carcinogenesis. 2010;31:27–36.[PMC free article] [PubMed]
126. Zhuang X, Xiang X, Grizzle W, Sun D, Zhang S, Axtell RC, Ju S, Mu J, Zhang L, Steinman L, Miller D, Zhang HG. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain. Mol Ther. 2011;19:1769–1779. [PMC free article][PubMed]
127. Sun D, Zhuang X, Xiang X, Liu Y, Zhang S, Liu C, Barnes S, Grizzle W, Miller D, Zhang HG. A novel nanoparticle drug delivery system: the anti-inflammatory activity of curcumin is enhanced when encapsulated in exosomes. Mol Ther. 2010;18:1606–1614. [PMC free article] [PubMed]
128. van Dommelen SM, Vader P, Lakhal S, Kooijmans SA, van Solinge WW, Wood MJ, Schiffelers RM. Microvesicles and exosomes: opportunities for cell-derived membrane vesicles in drug delivery. J Control Release. 2012;161:635–644. [PubMed]
129. Jang SC, Kim OY, Yoon CM, Choi DS, Roh TY, Park J, Nilsson J, Lötvall J, Kim YK, Gho YS. Bioinspired exosome-mimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors. ACS Nano. 2013;7:7698–7710. [PubMed]
Ключевые слова:
Экзомы, диагностика, лечение, биогенез экзосом
